全国首例!改写命运的宝宝昨在浙大妇院平安诞生
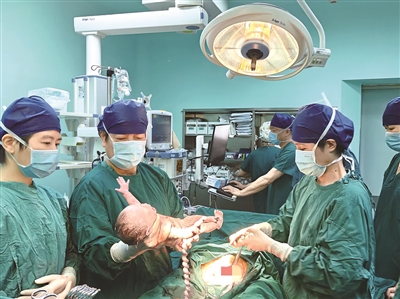
全国首例基于“乳腺癌综合风险AI预测模型”的健康宝宝昨天上午在浙大妇院产科手术室顺利降生
昨天上午8点36分,随着一声响亮的啼哭,浙大妇院湖滨院区产科手术室迎来了意义非凡的一刻。在中国科学院院士、浙江大学医学院院长、浙大妇院名誉院长黄荷凤院士团队的全程监护下,莺歌通过剖宫产顺利诞下一名2515克的女婴。
这是国内首例应用乳腺癌单基因PGT结合多基因风险评分的综合性评估模型的试管婴儿,标志着我国在遗传性肿瘤源头防控领域取得了重要进展。
手术后,莺歌紧紧握住医护人员的手:“感谢院士团队,感谢浙大妇院给了我和孩子改写命运的机会,给了宝宝一个远离乳腺癌阴影的未来。”
祖孙三代患癌
如何阻断遗传风险 突破基因“魔咒”?
莺歌的求子之路,一开始似乎就布满了阴影:她因子宫腺肌症、子宫内膜异位症导致原发不孕,并伴随有良性的右乳导管内乳头状瘤。而且,莺歌的外婆患有输卵管癌,舅公患肝癌去世,母亲因卵巢癌和乳腺癌也做过手术,莺歌本人也携带有BRCA1基因突变(该基因会使女性携带者70岁前患乳腺癌风险高达44%-78%)。
她一直担忧,未来自己有了孩子,能否突破这个遗传基因的“魔咒”?
全基因组关联研究(GWASs)已经成功地发现了一些与乳腺癌易感性相关的遗传变异位点,但单个变异的风险预测因素的能力有限,多基因风险评分(PRS)可以综合多个易感位点的效应,构建肿瘤风险预测模型,评估个体肿瘤的发生风险。但是,这样仍然不能排除多基因遗传导致的癌症风险。
有没有办法从单基因到多基因,进一步降低癌症风险呢?
AI赋能研究 用大数据筛查提高准确性
为了帮助莺歌和更多被癌症阴影笼罩的家族,黄荷凤院士提出了创新思路——在辅助生殖过程中,对复杂疾病通过多基因遗传风险评分方法,对胚胎进行多基因疾病遗传风险评估,筛选疾病风险最低的胚胎移植,从而实现多基因遗传病的一级防控。
在构建能够准确预测疾病发生的多基因风险评分(PRS)模型时,黄院士又创新性地提出,用AI大数据为研究赋能。
经过长达数个月的攻关,一个结合多种机制的乳腺癌风险评估综合模型终于构建完成。基于该模型,可预测乳腺癌终身风险。
2024年3月,莺歌利用先进的第三代试管婴儿技术(PGT),通过综合模型风险评估,成功获得了3枚珍贵的胚胎。得益于该技术的高成功率和个性化治疗方案,2024年11月,在治疗了子宫内膜相关疾病后,莺歌移植了一枚经过严格评估的低风险胚胎,并最终成功怀孕。
守护生命起点 创新赋能优生优育健康中国
莺歌怀孕之后,浙大妇院对她进行了全程密切管理。
这个小生命从孕育到出生的全过程,是黄荷凤院士团队“从生命源头降低慢病、癌症风险,阻断遗传性出生缺陷”探索之路上的一次新进展,也是我国在遗传性肿瘤源头防控方面取得的新突破。
“通过多基因风险评估,将慢病和肿瘤等疾病防控关口前移至胚胎选择阶段,实现从‘治已病’到‘防未病’的突破,是AI赋能生命早期防控慢病的一大重要创举。”浙大妇院副院长罗琼强调,这不仅是一次成功的分娩,更是“孕前-孕中-产后-长期”全链条全生命周期慢病健康管理的典范,将为许多具有家族性癌症风险的个体生育提供可复制的解决方案,是医院践行“健康中国”的具体体现。
“某些癌症具有家族聚集性倾向。如果一个家系中较多成员,在相同或不同器官发生恶性肿瘤,就更推荐其在生育前进行风险评估。”黄荷凤院士表示,对于有家族遗传病又有生育计划的适龄人群来说,通过运用综合模型风险评估,可以预测子代患有多基因遗传病的风险,以及预防肿瘤易感子代的出生,从源头防控出生缺陷。
(为保护隐私,文内患者为化名)